研究内容
1班「分子の機能性の理論的解析と分子設計」(設計グループ)
計算化学手法の開発と先導的応用
■担当:望月祐志
■概要:
計算機の高性能化やプログラムの進化に伴い、量子化学・計算化学による理論的な解析ないしシミュレーションが実験家に対して「一定の説得力」を持った情報を提供出来るようになってきた。しかし、凝集系での有機反応のモデリング、金属錯体の励起状態、あるいは巨大タンパク質の定量的な扱いなどでは、理論・プログラムの更なる改良が望まれている。
望月研究室では長年フラグメント分子軌道(FMO)法の方法論と独自プログラムの研究開発を進めてきているが、本プロジェクトでは計算精度の向上と並列処理を駆使した高速化を図ると共に、複数の電子配置の混在する反応系・錯体を低コストで記述可能な密度汎関数法やテンソル積分解系の技法の新規導入を計画している。応用計算では、FMO法の他に分子動力学(MD)なども併用してタンパク質やDNAの定量的計算を行うのはもちろん、ナノバイオの文脈でそれらの固体表面への吸着描像の導出なども手掛けたい。また、結晶や分子性固体の物性評価についてもFMO計算の適用を試みる予定である。

- 精度の高い4体FMOの基本式
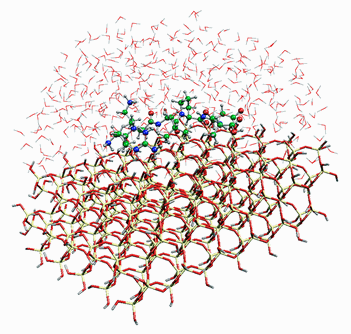
- シリカ上のペプチドのモデル
■論文:
1) “Dynamic fragmentation with static fragments
(DF/SF) algorithm designed for ab initio fragment
molecular orbital based-molecular dynamics (FMO-MD)
simulations for polypeptides” Komeij Y.; Fujiwara
T.; Okiyama Y.; Mochizuki Y. CBI-J. 2013,
13, 45-57.
2) “Three- and four-body corrected fragment
molecular orbital calculations with a novel
subdividing fragmentation method applicable to
structure-based drug design” Watanabe C.; Fukuzawa
K.; Okiyama Y.; Tsukamoto T.; Kato A.; Tanaka S.;
Mochizuki Y.; Nakano T. J. Mol. Gr. Mod.
2013, 41, 31-42.
3) “Improved description of the orbital relaxation
effect by practical use of the self-energy” Saitow
M.; Ida T.; Mochizuki Y., Intern. J. Quant. Chem.
2014, 114, 577-586.
4) “Accuracy of the fragment molecular orbital (FMO)
calculations for DNA: Total energy, molecular
orbital, and inter-fragment interaction energy”
Fukuzawa K.; Watanabe C.; Kurisaki I.; Taguchi N.;
Mochizuki Y.; Nakano T.; Tanaka S.; Komeiji Y. Comp.
Theor. Chem. 2014, 1034,
7-16.
5) "Electron-correlated fragment-molecular-orbital
calculations for biomolecular and nano systems"
Tanaka, S.; Mochizuki, Y.; Komeiji, Y.; Okiyama, Y.;
Fukuzawa, K. Phys. Chem. Chem. Phys.
2014, 16, 10310–10344.
6) "Interaction energy analysis on specific binding
of influenza virushemagglutinin to avian and human
sialosaccharide receptors: Importance of
mutation-induced structural change" Anzaki, S.;
Watanabe, C.; Fukuzawa, K.; Mochizuki, Y.; Tanaka,
S. J. Mol. Graph. Model. 2014,
53, 48–58.
7) "Fragment molecular orbital-based molecular
dynamics (FMO-MD) simulations on hydrated Cu(II)
ion" Kato, Y.; Fujiwara, T.; Komeiji, Y.; Nakano,
T.; Mori, H.; Okiyama, Y.; Mochizuki, Y. Chem-Bio
Informatics J. 2014, 14,
1–13.
8) "Optimal damping algorithm for unrestricted
Hartree-Fock calculations" Yamamoto, J.; Mochizuki,
Y. Chem-Bio Informatics J. 2014,
14, 14–33.
9) "Explicit solvation modulates intra- and
inter-molecular interactions within DNA: electronic
aspects revealed by the ab initio fragment molecular
orbital (FMO) method" Fukuzawa, K.; Kurisaki, I.;
Watanabe, C.; Okiyama, Y.; Mochizuki, Y.; Tanaka,
S.; Komeiji, Y. Comput. Theor. Chem.
2015, 1054, 29–37.
10) "Hydration effects on enzyme-substrate complex
of nylon oligomer hydrolase: inter-fragment
interaction energy study by the fragment molecular
orbital method" Ando, H.; Shigeta, Y.; Baba, T.;
Watanabe, C.; Okiyama, Y.; Mochizuki, Y.; Nakano, M.
Mol. Phys. 2015, 113,
319-326.
11) "Fragment molecular orbital-based molecular
dynamics study on hydrated Ln(III) ions", Fujiwara,
T.; Mori, H.; Komeiji, Y.; Mochizuki, Y. JPS-Conf.
Ser., 2015, 5, 011001.
12) "フラグメント分子軌道法を用いたspin-component-scaled
MP2法に基づくタンパク−リガンド相互作用クラスター解析", 甘利真司, 望月祐志, 加藤昭史,
福澤薫, 渡邉千鶴, 沖山佳生, 田中成典, 中野達也, CBI学会誌 2014, 2巻4号,
17-25.
13) "Modeling of hydroxyapatite-peptide interaction
based on fragment molecular orbital method", K.
Kato, K. Fukuzawa, Y. Mochizuki, Chem. Phys.
Lett., 2015, 629,
58-64.
14) "Reversible structural change accompanying
two-electron redox reaction of Pt(tacn) (tacn=
1,4,7-triazacyclononane) complexes", T. Wada, K.
Enami, R. Kojima, T. Okada, Y. Ishikawa, Y.
Miyazato, E. Horn, and Y. Mochizuki, Bull. Chem.
Soc. Jpn., in press.
理論設計支援による機能分子触媒の開発
■担当:山中正浩
■概要:
本研究では、量子化学計算の積極的な支援によって、これまで経験に支配されてきた不斉分子触媒設計を理論的設計へとパラダイムシフトさせ、類例のない高機能分子触媒を設計・開発することを目的としている。現在は、不斉分子触媒の構成要素としてアミジン骨格に着目し、その特徴的な共鳴安定化や水素結合ネットワークを基盤とする(1)複合機能型不斉分子触媒、(2)超分子型不斉分子触媒の開発を進めている(Fig. 1)。
(1)複合機能型不斉分子触媒
これまでに我々は、キラルビスアミジン触媒が共鳴安定化を駆動力として、ルイス−ブレンステッド複合酸触媒や複核金属触媒として機能することを見出している。α−ケトエステルの不斉合成反応を中心に、アルキル化反応、アルドール反応、ヒドロホスホニル化反応など、様々な不斉合成反応に最適な触媒機能を検討していく(Fig. 2)。
(2)超分子型不斉分子触媒
ルイス酸機能を有する反応制御部位に対してアミジン部位との水素結合ネットワークを介して立体制御部位を構築することで、目的の不斉合成反応に最適な触媒機能・構造を合理的かつ簡便に探索するために、新規な超分子型不斉分子触媒を計画している。Diels-Alder反応やEne反応などをプローブ反応として、本触媒の不斉触媒機能の精査と向上を行うと同時に超分子相互作用を活用した触媒設計指針を確立し、最終的には、本触媒独自の触媒的不斉合成の開発を目指す。
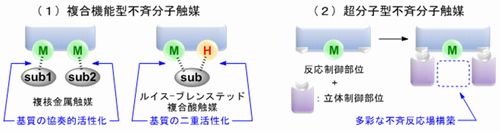
- Fig.1 触媒設計概念
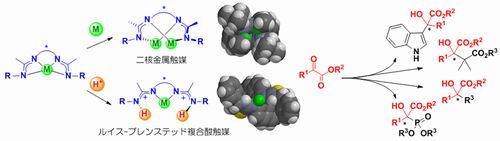
- Fig.2 α-ケトエステルの不斉合成反応
■論文:
1)“Theoretical Study on the Regioselectivity of
Baeyer-Villiger Reaction of α-Me-, -F-,
-CF3-Cyclohexanones” Itoh, Y.; Yamanaka,
M.; Mikami, K. J. Org. Chem. 2013,
78, 146-153.
2)“Enantioselective Synthesis of Multisubstituted
Biaryl Skeleton by Chiral Phosphoric Acid Catalyzed
Desymmetrization/Kinetic Resolution Sequence” Mori,
K.; Ichikawa, Y.; Kobayashi, M.; Shibata, Y.;
Yamanaka, M.; Akiyama, T. J. Am. Chem. Soc.
2013, 135, 3964-3970.
3)“DFT Study of Mechanism and Origin of
Enantioselectivity in Chiral BINOL-Phosphoric Acid
Catalyzed Transfer Hydrogenation of Ketimine and
α-Imino Ester Using Benzothiazoline” Shibata, Y.;
Yamanaka, M. J. Org. Chem. 2013,
78, 3731-3736.
4)“Investigation of the Carboxylate Position during
the Acylation Reaction Catalyzed by Biaryl DMAP
Derivatives with an Internal Carboxylate” Nishino,
R.; Furuta, T.; Kan K.; Sato, M.; Yamanaka, M.;
Sasamori, T.; Tokitoh, N.; Kawabata, T. Angew.
Chem. Int. Ed. 2013, 52,
6445-6449.
5)“Chiral Phosphoric Acid-Catalyzed Oxidative
Kinetic Resolution of Indolines Based on Transfer
Hydrogenation to Imines” Saito, K.; Shibata, Y.;
Yamanaka, M.; Akiyama, T. J. Am. Chem. Soc.
2013, 135, 11740-11743.
6)“Prediction of suitable catalyst by 1H NMR:
asymmetric synthesis of multisubstituted biaryls by
chiral phosphoric acid catalyzed asymmetric
bromination” Mori, K.; Ichikawa, Y.; Kobayashi, M.;
Shibata, Y.; Yamanaka, M.; Akiyama, T. Chem. Sci.
2013, 4, 4235-4239. “Most
Downloaded Article”
7)“Mechanistic study of asymmetric Michael addition
of malonates to enones catalyzed by a primary amino
acid lithium salt” Yoshida, M.; Nagasawa, Y.;
Kubara, A.; Hara, S.; Yamanaka, M. Tetrahedron
2013, 69, 10003-10008.
8)“Double C(sp3)-H Bond Functionalization
Mediated by Sequential Hydride Shift/Cyclization
Process: Diastereoselective Construction of
Polyheterocycles” Mori, K.; Kurihara, K.; Yabe, S.;
Yamanaka, M.; Akiyama, T. J. Am. Chem. Soc.
2014, 136, 3744-3747.
9)“Trinuclear
Zn3(OAc)4-3,3’-bis(aminoimino)binaphthoxide
Complex for Highly Efficient Catalytic Asymmetric
Iodolactonization” Arai, T.; Sugiyama, N.; Masu, H.;
Kado, S.; Yamanaka, M. Chem. Comm.
2014, 50, 8287-8290.
10)“Chiral Phosphoric-Acid-Catalyzed Transfer
Hydrogenation of Ethyl Ketimine Derivatives by Using
Benzothiazoline” Saito, K.; Horiguchi, K.; Shibata,
Y.; Yamanaka, M.; Akiyama, T. Chem. Eur. J.
2014, 20, 7616-7620.
11)“Theoretical Studies on Mechanisms and Origins of
Stereocontrol in Chiral Phosphoric Acid Catalyzed
Asymmetric Reactions” Yamanaka, M.; Shibata, Y.
J. Syn. Org. Chem. 2014,
72, 580-595.
12)“DFT Studies of Mechanism and Origin of
Stereoselectivity of Palladium-Catalyzed
Cyclotrimerization Reactions Affording
syn-Tris(norborneno)benzenes” Yamanaka, M.;
Morishima, M.; Shibata, Y.; Higashibayashi, S.;
Sakurai, H. Organometallics 2014,
33,
3060-3068.
13)“Asymmetric Michael Addition of β-Ketoesters to
Enones Catalyzed by the Lithium Salt of a Primary
β-Amino Acid” Yoshida, M.; Kubara, A.; Nagasawa, Y.;
Hara, S.; Yamanaka, M. Asian J. Org. Chem.
2014, 4, 523-529.
14)“Secondary stereocontrolling interactions in
chiral Bronsted acid catalysis: study of a
Petasis-Ferrier-type rearrangement catalyzed by
chiral phosphoric acids” Kanomata, K.; Toda, Y.;
Shibata, Y.; Yamanaka, M.; Tsuzuki, S.; Gridneva, I.
D.; Terada, M. Chem. Sci. 2014,
5,
3515-3523.
15)“Origin of Stereocontrol in Guanidine-Bisurea
Bifunctional Organocatalyst That Promotes α
Hydroxylation of Tetralone-Derived β Ketoesters:
Asymmetric Synthesis of β- and γ Substituted
Tetralone Derivatives via Organocatalytic Oxidative
Kinetic Resolution” Odagi, M.; Furukori, K.;
Yamamoto, Y.; Sato, M.; Iida, K.; Yamanaka, M.;
Nagasawa, K. J. Am. Chem. Soc. 2015,
137, 1909-1915.
16)“Origin of High E Selectivity
in 4 Pyrrolidinopyridine-Catalyzed Tetrasubstituted
α,α′-Alkenediol: A Computational and Experimental
Study” Yamanaka, M; Yoshida, U.; Sato, M.; Shigeta,
T.; Yoshida, K.; Furuta, T.; Kawabata, T. J.
Org. Chem. 2015, 80,
3075-3082.
17)“Benzothiazoline: Versatile Hydrogen Donor for
Organocatalytic Transfer Hydrogenation” Zhu, C.;
Saito, K.; Yamanaka, M; Akiyama, T. Acc. Chem.
Res. 2015, 48,
388−398
18)“PyBidine–Cu(OTf)2-Catalyzed
Asymmetric [3+2] Cycloaddition with Imino Esters:
Harmony of Cu–Lewis Acid and Imidazolidine-NH
Hydrogen Bonding in Concerto Catalysis” Arai, T.;
Ogawa, H.; Awata, A.; Sato, M.; Watabe, M.;
Yamanaka, M Angew. Chem. Int. Ed.
2015, 54, 1595-1599.
水素結合ネットワークを利用した分子認識による不斉触媒反応の自在制御
■担当:堤亮祐
■概要:
生体における酵素反応では、水素結合を中心とした複数の非共有結合性相互作用の協働により酵素が基質を精密に認識することで、高度に位置・立体選択的な分子変換が実現されている。 本研究では金属–ブレンステッド酸複合触媒に注目し、水素結合ネットワークを利用する反応基質の認識を鍵として、酵素に匹敵する高機能触媒の開発に取り組む。すなわち、ルイス酸、酸化還元活性等の反応の推進力を持つ金属に対し、基質の配向を厳密に規定するための水素結合部分を組み合わせる触媒設計により、反応の位置・立体の両選択性の自在制御に挑む(Fig. 1)。
(1)不斉付加反応における立体・位置選択性の制御
酸・塩基型反応の代表例である付加反応を取り上げ、潜在的に複数の反応点を持つ基質の反応の位置・立体の両選択性を同時制御できる触媒系を創出する。特に通常とは異なる位置選択性の獲得、最小限の反応条件の調整による位置・立体異性体のスイッチングに焦点を当てた反応開発に取り組む(Fig.2左)。
(2)不斉遷移金属触媒反応における立体・位置選択性の制御
前項と並行して、酸・塩基型以外の触媒作用を持つ様々な遷移金属を用いる立体・位置選択反応の開発を行う。配位性官能基を持つ基質を不斉触媒上の水素結合供与部位によって精密に認識することで、立体選択性のみならず、位置異性体の作り分けを可能にする(Fig.2右)。
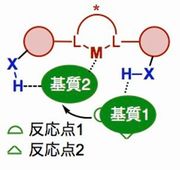
- Fig.1 金属–ブレンステッド酸複合触媒
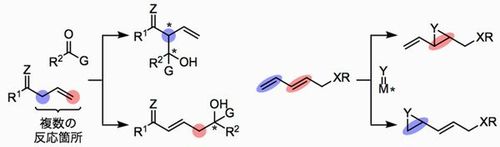
- Fig.2 触媒による立体・位置選択性の制御
■論文:
1) “Catalytic Asymmetric Oxidation of N-Sulfonyl Imines with Hydrogen Peroxide–Trichloroacetonitrile System”
Uraguchi, D.; Tsutsumi, R.; Ooi, T. J. Am. Chem. Soc. 2013, 135, 8161–8164.
2)“Catalytic Asymmetric Payne Oxidation under the Catalysis of P-Spiro Chiral Triaminoiminophosphorane: Application to the Synthesis of N-Sulfonyl Oxaziridines”
Uraguchi, D.; Tsutsumi, R.; Ooi, T. Tetrahedron 2014, 70, 1691–1701
3) “Practical Preparation of Chiral N-Sulfonyl Oxaziridines by Catalytic Asymmetric Payne Oxidation”
Tsutsumi, R.; Kim, S.; Uraguchi, D.; Ooi, T. Synthesis 2014, 46, 871–878.
4)“Ruthenium-Catalyzed C–C Coupling of Amino Alcohols with Dienes via Transfer Hydrogenation: Redox-Triggered Imine Addition and Related Hydroaminoalkylations”
Chen, T.-Y.; Tsutsumi, R.; Montgomery, T. P.; Volchkov, I.; Krische, M. J. J. Am. Chem. Soc. 2015, 137, 1798−1801.
5) “Diastereo- and Enantioselective Iridium Catalyzed Carbonyl (α-Cyclopropyl)allylation via Transfer Hydrogenation”
Tsutsumi, R.; Hong, S.; Krische, M. J. Chem.—Eur. J. 2015, 21, 12903−12907