研究内容
2班「反応に基づく機能を有する分子・分子材料の開発」(反応制御グループ)
自然界におけるテルペン化合物の設計と制御および多様性
■担当:黒田智明
■概要:
植物はさまざまなテルペン化合物を生産する。多様な化合物群と、それらを生産する植物の生育状況との関係を把握することを通じて、自然界が行っている分子設計についての理解を深めることを目的とする。
我々は、中国横断山脈におけるキク科リグラリア属植物が産するセスキテルペン等を題材として、その多様性の実態を記述してきた。リグラリア属植物の多くがフラノエレモフィラン化合物を生産する。我々は、フラノエレモフィランを生産する種(あるいは種内グループ)はその前駆体と考えられるエレモフィラン−8−オン誘導体を産する種(同)より生態的に有利であるとの仮説を提唱している1(Fig. 1)。また、セスキテルペン生産能は雑種形成過程を経て獲得してきた、と考えられている2。本研究では、これらの仮説の立証に向け、さらなる試料、特に雑種と考えられる試料の分析を進め、新たな知見を得ることを目指す。現地調査もさらに継続して進める(Fig. 2に現地の例を示す)。
一方、高度に酸化されたビサボラン型セスキテルペンを生産する種も存在する。それらのビサボラン化合物は側鎖に不斉炭素原子を2つ有するが、その立体配置は決められていない。本研究ではその立体構造の決定に向け、Fig. 3に示すエポキシ化合物(Rはエステルの酸部分)の4つの可能な立体異性体を合成する。これによって、天然物の立体構造に関する理解が深まるものと予想される。
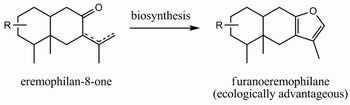 Fig.1 フラノエレモフィランの生合成と生態 | |
 Fig.2 現地における植物の例 |
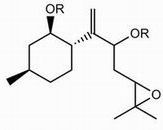 Fig.3 ビザボランモデル化合物 |
■論文:
1)“Eight New Alkyne and Alkene Derivatives from Four
Saussurea Species Collected in China” Saito, Y.;
Iwamoto, Y.; Okamoto, Y.; Kawahara, T.; Gong, X.;
Kuroda, C.; Tori, M. Nat. Prod. Commun.
2013, 8, 631-634.
2)“Four new compounds from Ligularia virgaurea:
isolation of eremophilane and noreremophilane
sesquiterpenoids and the absolute configuration of
2α-hydroxyeremophil-11-en-9-one by CD spectrum and DFT
calculation” Saito, Y.; Taniguchi, M.; Komiyama, T.;
Ohsaki, A.; Okamoto, Y.; Gong, X.; Kuroda, C.; Tori, M.
Tetrahedron 2013, 69,
8505-8510.
3)“Chemical and Genetic Diversity of Cremanthodium
lineare” Saito, Y.; Ichihara, M.; Takiguchi, K.;
Tanio, Y.; Okamoto, Y.; Hanai, R.; Kuroda, C.; Kawahara,
T.; Gong, X.; Tori, M. Phytochemistry
2013, 96, 184-190.
4)“Phylogenetic patterns and disjunct distribution in
Ligularia hodgsonii Hook. (Asteraceae)” Wang,
J.-F.; Gong, X.; Chiang, Y.-C.; Kuroda, C. J.
Biogeography 2013, 40,
1741-1754.
5)“The First Isolation of Furanoeremophilane from
Ligularia nelumbifolia” Hirota, H.; Horiguchi, Y.;
Kawaii, S.; Hanai, R.; Gong, X.; Kuroda, C. Nat. Prod.
Commun. 2014, 9, 325-327.
6)“Twelve new compounds from Ligularia melanothyrsa;
isolation of melanothyrsins A-E, normelanothyrsin A, and
other eremophilane sesquiterpenoids” Saito, Y.;
Ichihara, M.; Okamoto, Y.; Gong, X.; Kuroda, C.; Tori,
M. Tetrahedron 2014, 70,
2621-2628.
7)“Chemical and genetic similarity and diversity of
Ligularia anoleuca and L. fischeri
collected in the Hengduan Mountains of China” Shimizu,
A.; Suzuki, Y.; Hanai, R.; Okamoto, Y.; Tori, M.; Gong,
X.; Kuroda, C. Phytochemistry 2014,
102, 137-144.
8)“中国横断山脈地域に生育するキク科Ligularia属植物の生産するフラノエレモフィラン化合物の多様性”
黒田智明, 花井 亮, 通 元夫, 岡本育子, 齋藤義紀, 永野 肇, 大崎愛弓, 廣田 洋, 河原孝行,
龔 洵. 有機合成化学協会誌
2014, 72, 717-725.
9)“Chemical and Genetic Study on Hybrid of Ligularia
subspicata and L. cyathiceps Collected in Yunnan
Province of China” Shimizu, A.; Watanabe, S.; Hanai, R.;
Okamoto, Y.; Tori, M.; Gong, X.; Kuroda, C. Chem.
Biodiversity 2014, 11, 1438-1448.
10)“Structure and Cytotoxic Evaluation of 12-Oxygenated
Eremophilanes from Ligularia lingiana” Saito, Y.;
Sasaki, Y.; Komiyama, T.; Ohsaki, A.; Okamoto, Y.; Gong,
X.; Kuroda, C.; Tori, M. Tetrahedron
2014, 40, 5878-5883.
11)“Isolation and structure of three bislactones,
eremopetasitenin B4, eremofarfugins F, and G, from
Ligularia przewalskii and revision of the structure of
an epoxy-lactone isolated from Ligularia intermedia”
Saito, Y.; Kamada, A.; Okamoto, Y.; Gong, X.; Kuroda,
C.; Tori, M. Chem. Lett. 2014,
43, 1740-1742.
12)“Germacranolides and their diversity of
Eupatorium heterophyllum collected in China” Saito,
Y.; Mukai, T.; Iwamoto, Y.; Baba, M.; Takiguchi, K.;
Okamoto, Y.; Gong, X.; Kawahara, T.; Kuroda, C.; Tori,
M. Chem. Pharm. Bull. 2014,
62, 1092-1099.
13)“Structures of Six New Compounds from Ligularia
brassicoides” Saito, Y.; Sasaki, Y.; Ohsaki, A.;
Okamoto, Y.; Gong, X.; Kuroda, C.; Tori, M. Tetrahedron
2014, 70, 9726-9730.
14)“Natural Hybridization and Introgression between
Ligularia cymbulifera and L. tongolensis
(Asteraceae, Senecioneae) in Four Different Locations”
Yu J.; Kuroda, C.; Gong, X. Plos One,
2014, e115167.
15)“Chemotypes of Ligularia vellerea, its hybrids, and
L. melanothyrsa” Shimizu, A.; Inoue, K.;
Ichihara, M.; Hanai, R.; Saito, Y.; Okamoto, Y.; Tori,
M.; Gong, X.; Kuroda, C. Nat. Prod. Commun.
2015, 10, 9-12.
16)“Diversity in the Flavonoid Composition of Stellera
chamaejasme in the Hengduan Mountains” Shirai, K.;
Okamoto, Y.; Tori, M.; Kawahara, T.; Gong, X.; Noyama,
T.; Watanabe, E.; Kuroda, C. Nat. Prod. Commun.
2015, 10, 53-56.
17)“Chemical and Genetic Diversity of Ligularia
hodgsonii in China” Kuroda, C.; Inagaki, K.; Chao, X.;
Inoue, K.; Okamoto, Y.; Tori, M.; Gong, X.; Hanai, R.
Natural Product Communications, 2015, in press.
18)“Synthesis and NMR Spectroscopic Elucidation of Four
Diastereoisomers of Oxygenated Bisabolane Side Chain”
Hirai, M.; Miyazaki, R.; Mitsui, K.; Kiuchi, K.; Onuki,
H.; Hirota, H.; Kuroda, C. Helvetica Chimica Acta,
2015, in
press.
論理的分子設計に基づいたエネルギー変換錯体触媒の開発
■担当:和田亨
■概要:
環境・エネルギー問題の解決に向けて、光あるいは電気エネルギーと化学エネルギーの変換を行うための化学反応を触媒する物質の開発が求められている(Fig.1)。現在、盛んに人工光合成の研究が行われているが、現状では水を酸化し酸素を発生する触媒の性能がボトルネックとなっている。二酸化炭素の多電子還元触媒については、この20年ほど大きな進歩がない。本研究では、水や二酸化炭素などの安定な小分子を活性化するために論理的に設計された金属錯体触媒を開発することを目的とする。
これまでに、我々は二核化配位子ビス(ターピリジル)アントラセン(btpyan)を用いて合成した二核金属錯体(Fig.2)が、その二つの金属間で二原子分子を生成・活性化するのに極めて適した構造であることを明らかにしている。中心金属としてルテニウムを用いると水の四電子酸化反応1,2(式1の順反応)を、コバルトを用いると酸素の四電子還元反応3を触媒する(式1の逆反応)。
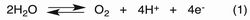
本研究では、天然の光合成を模倣した構造を組み込むことにより、電子とプロトンの移動を制御した新たな水と酸素の相互変換触媒を開発する。設計グループとのコラボレーションにより、二分子の水から酸素—酸素結合を形成する機構の解明を行い、更なる高活性触媒の開発を目指す。さらに二酸化炭素の六電子還元によるメタノール生成を目指して、異種金属二核錯体触媒を合成する。
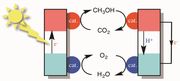
- Fig. 1 循環型エネルギー変換システムのイメージ
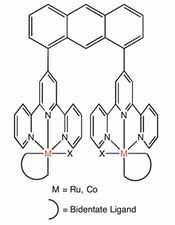
- Fig. 2 二核錯体触媒の構造
■論文:
1) “Reversible structural changes accompanying the
two-electron redox reaction of Pt(tacn) (tacn =
1,4,7-triazacyclononane) complexes” Wada, T.; Enami,
K.; Kojima, R.; Okada, T.; Ishikawa, Y.; Miyazato,
Y.; Horn, E.; Mochizuki, Y. Bull. Chem. Soc. Jpn.
2015, accepted.
2) “Four-electron reduction of dioxygen catalyzed by
dinuclear cobalt complexes bridged by
bis(terpyridyl)anthracene.” Wada, T.; Maki, H.;
Imamoto, T.; Yuki, H.; Miyazato, Y., Chem.
Commun. 2013, 49 (39),
4394-4396.
3) “Catalytic Four-Electron Oxidation of Water by Intramolecular Coupling of the Oxo Ligands of a Bis(ruthenium-bipyridine) Complex.” Wada, T.; Ohtsu, H.; Tanaka, K. Chem., Eur. J.
2012, 18, 2374-2381.
流通式分離系を利用する化学特性解析
■担当:宮部寛志
■概要:
流通式分離法(クロマトグラフィーや電気泳動法)では、分離対象成分と固定相表面修飾基やリガンドとの間の化学的相互作用、及び分離系内における物質移動現象の無数の繰り返しによって分離が達成される。このため、その分離挙動を解析することにより分子間相互作用や物質移動に関する化学情報を得ることができる(Fig. 1)。
このうち分子間相互作用は、化学物質の特性解析、生体機能の発現機構の解明や、医薬品候補化合物のスクリーニング等との関連で活発に研究が行われている。流通式分離法は従来から相互作用の平衡論的解析法として利用されてきたが、近年その平衡情報だけではなく速度情報の解析が重要になってきていることから、これに対応して速度解析をも行える解析法として展開するためには、その基盤となる新たな解析理論を構築する必要がある。
そこで、解析の基盤となるモーメント式の導出について検討を行った(Fig. 2)。分子間相互作用速度をLangmuir型の速度式で表わす場合、モーメント式は(式1)及び(式2)のように表わされる。飽和吸着量(q*)を別途測定すれば、溶出ピークの一次モーメント(μ1)と二次モーメント(μ2’)から結合速度定数(κa)と解離速度定数(κd)の各々の値、及び相互作用に関する平衡論的情報(結合定数や解離定数)を求めることができる。
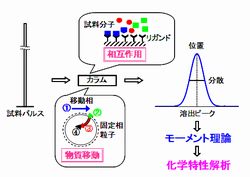
- Fig1. パルス応答法による化学特性解析
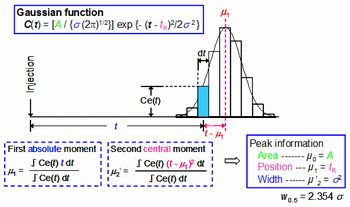
- Fig.2 溶出ピークのモーメントの概説
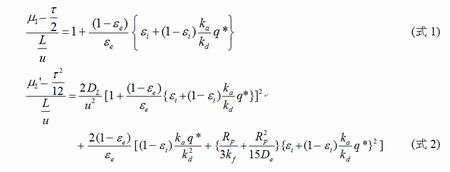
■論文:
1)“Measurement of Pore Diffusivity in Separation
Media for High Performance Liquid Chromatography”
Miyabe, K.; Matsumoto, Y.; Ando, N.; Teratani Y.
Anal. Sci. 2013, 29,
315-323.
2)“Estimation of Molecular Diffusivity in Liquid
Phase Systems on the Basis of the Absolute Rate
Theory” Miyabe, K.; Isogai, R. Anal. Sci.
2013, 29, 467-472.
3)“Moment Equations for Chromatography Based on
Langmuir Type Reaction Kinetics” Miyabe, K. J. Chromatogr. A 2014, 1356,
171-179.
4)“Moment Analysis of Chromatographic Behavior of
Separation Media for Fast HPLC” Miyabe, K.; Murata,
Y. Anal. Sci. 2014, 30, 277-283.
5)“Kinetic Study of Intermolecular Interaction
between 2-Phenoxypropionic Acid and
β-Bromo-cyclodextrin Affixed on Stationary Phase by
Liquid Chromatography” Miyabe, K.; Kamiya, S.
Anal. Sci. 2015, 31,
In press.
6)“Kinetic Study of Interaction between Solute
Molecule and Surfactant Micelle” Miyabe, K.;
Takahashi, R.; Shimazaki, Y. Anal. Sci.
2015, 31, In press.
高周期典型元素を含む機能性化合物の創製と反応開発
■担当:箕浦真生
■概要:
第三周期以降の16族元素(Ch = S, Se, Te)は、通常の2価の他に4価、 6価を有し得るため、化合物群の多様性の観点から、近年興味が持たれている。
これまでに担当者のグループでは、遷移金属化学種に限られていた5および6配位化合物の特徴有る構造と性質を、典型元素に見出す事を目的とし、6価有機テルル化合物に着目し、芳香環を6つ有する元素の初めての例として、ヘキサアリールテルル(Ar6Te, Ar = Ph-, p-CF3C6H4-)の合成に成功しその性質を明らかにした。また、容易に官能基導入が可能なAr5TeX (X = Cl, OTf, etc.)などの化合物群の合成法を開発してきた。
本研究では、アルキル基や芳香族置換基などの炭素配位子のみを有する新しい6価16族元素化合物群(R4Ch, R5Ch-, R5Ch+, R6Ch)を新規かつ系統的に合成し、未開拓である6価典型元素化合物群の90度に直交する結合の性質を解明し、分子構築の「素子(=核)」としての特性を見出すことを目的としている。また、機能性官能基の導入と分子配列のデザインを行い、典型元素を核とする前例のないオクタヘドラル空間での多修飾機能物質の合成を目指す。
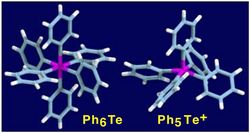
- Fig.1 安定な6価有機テルル化合物
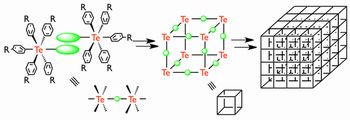
- Fig.2 6価典型元素を核とするオクタヘドラル空間での官能基配列
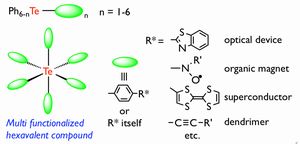
- Fig.3 多修飾機能性分子構築素子
■論文:
1)“Synthesis of New Dipyrido-Annulated
N-Heterocyclic Carbenes with Ortho Substituents”
Fuku-en, S.-i.; Yamamoto, J.; Minoura, M.; Kojima,
S.; Yamamoto, Y. Inorg. Chem. 2013,
52, 11700-11702.
2)“Synthesis, Structure, and Reactivity of Lewis
Base Stabilized Plumbacyclopentadienylidenes,”
Saito, M.; Akiba, T.; Kaneko, M.; Kawamura, T.; Abe,
M.; Hada, M.; Minoura, M. Chem., Eur. J.
2013, 19, 16946-16953.
3)“Studies on Chalcogen-containing Heterocycles.
Part 38: Regio- and Stereoselective Tandem
Addition-iodocyclization of 2-Ethynylphenyl
Isothiocyanates with N- and O-Nucleophiles
Affording 4-(Iodoalkylidene)benzo[d][1,3]thiazines”
Sashida, H.; Kaname, M.; Minoura, M. Tetrahedron
2013, 69, 6478-6487.
4)“Synthesis and Structures of Monomeric Group 14
Triols and Their Reactivity” Pop, L.-C.; Kurokawa,
N.; Ebata, H.; Tomizawa, K.; Tajima, T.; Ikeda, M.;
Yoshioka, M.; Biesemans, M.; Willem, R.; Minoura,
M.; Saito, M. Can. J. Chem. 2014,
92, 542-548.
5)“Unexpected Dehalogenation Reactions of
Dichloroborane Bearing a NCN-Pincer Ligand:
Formation of a Borenium Salt” Saito, M.; Matsumoto,
K.; Fujita, M.; Minoura, M. Heteroat. Chem.
2014, 25, 354-360.
6)“Synthesis, Structure, and Thermolysis of
Tetracoordinated 1λ4,2-Selenazetidines Bearing Two
Chiral Centers at the 3- and 4-Positions” Daicho,
Y.; Kano, N.; Yukimoto, M.; Minoura, M.; Kawashima,
T. Heteroat. Chem. 2014,
25, 492-499.
7)“Aziridine formation with retention of
configuration from a pentacoordinated
1,2-thiazetidine bearing two chiral centers at the
3- and 4-positions” Daicho, Y.; Watanabe, Y.; Kano,
N.; Yukimoto, M.; Minoura, M.; Kawashima, T.
Bull. Chem. Soc. Jpn. 2014,
87, 1005-1012.
8)“Enhancement of stannylene character in stannole
dianion equivalents evidenced by NMR and Mossbauer
spectroscopy and theoretical studies of newly
synthesized silyl-substituted
dilithiostannoles”Kuwabara, T.; Guo, J.-D.; Nagase,
S.; Minoura, M.; Herber, R. H.; Saito, M.
Organometallics 2014, 33,
2910-2913.
9)“Fluorinative hydrolysis of phosphorothioic acid
esters with a binaphthyl group through
axis-to-center chirality transfer leading to the
formation of P-chiral phosphorothioic monofluoridic
acid salts” Murai, T.; Hayashi, T.; Yamada, K.;
Maekawa, Y.; Minoura, M. Chem. Commun.
2014, 50, 12473-12475.
分子性触媒を基盤とした高効率な光エネルギー変換反応系の構築
■担当:中薗孝志
■概要:
近年、化石燃料の代替エネルギーの研究開発に大きな注目が寄せられている。人工光合成は、無尽蔵な太陽光エネルギーを用いて水から酸素を発生させ、得られたプロトン及び電子を用いて水素ガスや二酸化炭素の還元生成物などの化学エネルギーに変換する技術として注目されている。この達成のためには、それぞれの反応を促進する優れた触媒の開発が必要不可欠である。
我々はコバルトポルフィリン錯体(Fig. 1)の触媒作用に着眼し、その活性制御要因ならびに耐久性制御に関する研究を多角的に展開してきた。さらに、配位子に嵩高い置換基を導入することで、光酸素発生反応中における触媒分子の分解過程の立体制御を行い、触媒活性、耐久性の飛躍的向上に成功した。
本研究では多電子酸化反応に有利な新規多核錯体触媒の開発を行い、光酸素発生反応(Fig. 2)をはじめとした触媒反応への応用を目指す。その触媒反応機構を解明し、さらに高活性な触媒を設計する知見を得ることを目指す。
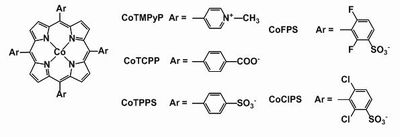
- Fig1. コバルトポルフィリン錯体の構造
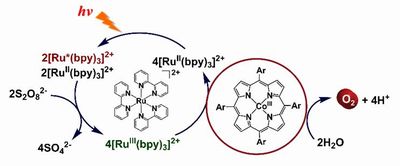
- Fig.2 光酸素発生触媒反応系
■論文:
1)“Cobalt Porphyrins as Homogeneous Catalysts for Water Oxidation”
Takashi Nakazono, Alexander Rene Parent, and Ken Sakai,
Chem. Commun., 2013, 49, 6325-6327.
2)“Mechanism of Water Oxidation by Non-Heme Iron Catalysts when Driven with Sodium Periodate”
Alexander Rene Parent, Takashi Nakazono, Shu Lin, Satoshi Utsunomiya, and Ken Sakai,
Dalton Trans., 2014, 43, 12501-12513.
3)“Improving Singlet Oxygen Resistance during Photochemical Water Oxidation by Cobalt Porphyrin Catalysts”
Takashi Nakazono, Alexander Rene Parent, and Ken Sakai,
Chem. Eur. J., 2015, 21, 6723-6726.
4)“Photochemical Water Oxidation Catalyzed by a Water-Soluble Copper Phthalocyanine”
Ryota Terao, Takashi Nakazono, Alexander Rene Parent, and Ken Sakai,
ChemPlusChem, 2016, 81, 1064-1067.
5)“Improving the Robustness of Cobalt Porphyrin Water Oxidation Catalysts by Chlorination of Aryl Groups”
Takashi Nakazono* and Ken Sakai, Dalton Trans., 2016, 45, 12649-12652.