立教大学 理学部 生命理学科 細胞生化学研究室

タンパク質チロシンホスファターゼ
タンパク質のチロシン残基のリン
酸化はタンパク質チロシンリン酸化酵素(チロシンキナーゼ)とタンパク質チロシン脱リン酸化酵素(チロシンホスファターゼ)によって制御されている。タンパク質のチロシン残基のリン酸化は様々な細胞内シグナル伝達において重要な働きをしていることが報告されているが、そのシグナル伝達機構の解明には、チロシンキナーゼと同様にチロシンホスファターゼの研究は欠かせない。
当研究室ではアレルギー反応に関わる細胞であるマスト細胞の活性化シグナルや繊維芽細胞における細胞接着や細胞移動の制御に関わるシグナル伝達において、チロシンホスファターゼがどのような役割を担っているか検討している。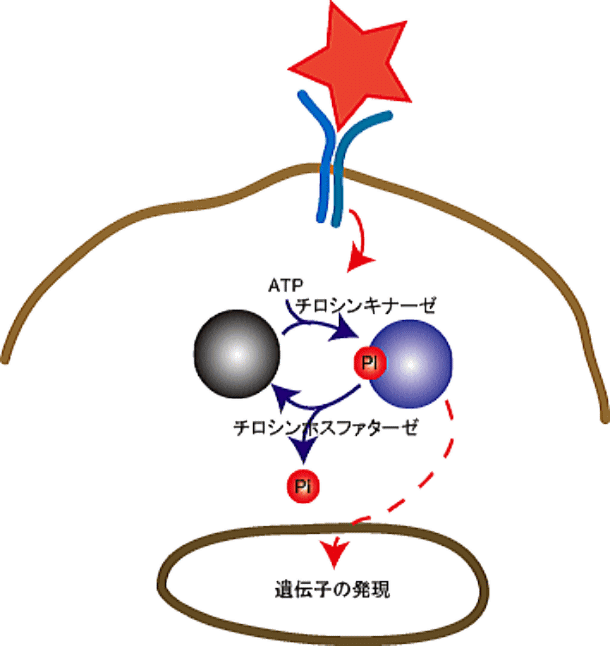
チロシンホスファターゼは、酵素活性(PTP)ドメインと多様な構造を示す非酵素領域からなる多種の分子が知られており、スーパーファミリーを形成している。当研究室では、その中から細胞質型チロシンホスファターゼであるPTP-PEST
(PTPN12)と受容体型チロシンホスファターゼであるPTP-ε(PTPRE)に注目して研究を進めている。
PICOT/Grx3
T細胞において、Protein kinase C-θと特異的に結合する分子として単離されたPICOT (PKC-interacting cousin of thioredoxin)は1個のthioredoxin-likeドメインと2個のglutaredoxinドメインを持っている。現在ではPICOTはmonothiol glutaredoxinとして働いていると考えられている。私たちはマスト細胞においてPICOTはFcεRI架橋による脱顆粒を正に制御していることなどを報告している。現在、マスト細胞におけるPICOTの詳細な機能解析を行っている。
![]() PICOT/Grx3
PICOT/Grx3
最近の研究
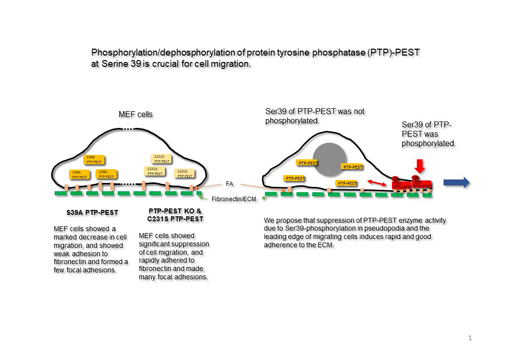
Phosphorylation/dephosphorylation of PTP-PEST at Serine 39 is crucial for cell migration (PTP-PESTのSer39のリン酸化・脱リン酸化が細胞の移動に重要である)
PTP-PESTの酵素活性はSer39のリン酸化によって抑制されるが、Ser39をアラニン残基に置換した変異PTP-PESTを持つMEF細胞の細胞移動は強く抑制されることが分かった。さらに、PTP-PESTの酵素活性は細胞のフィブロネクチンへの接着、接着斑 (focal adhesion)の形成を抑制することが分かった。また、Ser39がリン酸化されたPTP-PESTの細胞内局在を調べたところ、仮足にあるPTP-PESTが局所的にSer39がリン酸化されていることが分かった。以上の結果から、PTP-PESTのSer39が局所的にリン酸されることが細胞移動において重要であることをが分かった。
J. Biochem. 2023, 173, 73-84
その他